Le site des ophtalmologistes de France
Encyclopédie de la vue
Vous êtes ici
Thérapie génique
Thérapie génique
1) Frankenstein: une introduction à la thérapie génique ?
Des chercheurs ont créé ce que la Nature n'a pas osé imaginer. En effet le mensuel Nature Biotechnology, de février 2002, relate le travail de l'équipe japonaise du Pr Shigeyuki Yokohama (Université de Tokyo). Elle a créé une nouvelle paire de nucléotides qui fut incorporée dans de l'ADN d'Escherichia coli. Ainsi aux quatres bases naturelles A(adénine), G(guanine), T(thymine) et C(cytosine), les japonais ont ajouté les bases S (2-amino-6-(2-thienyl)purine) et Y (pyridin-2-one). Ceci a permis la formation d'un nouvel acide aminé non naturel, la 3-chlorotyrosine.

On va ainsi parvenir à créer des organismes chimériques inconnus sur Terre...
Une société pratiquant l'evolutionary biotechnology history (évolution dirigée) : Evologic (pas de site internet pour l'instant mais le nom evologic est réservé).
2) La thérapie génique, qu'est ce que c'est ?

ADN en double hélice
Il s'agit d'une nouvelle approche thérapeutique, qui consiste à adapter le fonctionnement des cellules de l'organisme en modifiant, dans chaque cellule, les commandes qui sont situées dans les chromosomes. Cela doit permettre de soigner certaines maladies (rôle curatif) ou, un jour, d'éviter que certaines pathologies ne surviennent (rôle préventif).
On imagine ainsi proposer dans l'avenir cette thérapie en ophtalmologie pour différentes maladies que l'on va citer. Le nombre de patients atteints est primordial pour susciter des recherches; certaines maladies orphelines ont peu d'espoir d'intéresser la recherche dans un premier temps.
3) Historique de la thérapie génique
Les années 80 permirent d'explorer l'ensemble des gènes humains, le génome, et de les répertorier. On pense qu'on connaitra la totalité des gènes humains d'ici quelques années. Cette science est la génomique, qui demande beaucoup de travail et d'argent pour accéder à ce décryptage.
Les premières tentatives thérapeutiques apparurent en 1990 grâce à une stratégie ex vivo : les cellules du patient sont prélevées et vont être cultivées en laboratoire en association avec les vecteurs. Une fois leur ADN modifiée, elles sont réinjectées au patient.Les chercheurs se sont rendus compte que l'expression du gène n'est pas toujours efficace. Les premières maladies que l'on pensait traiter était la myopathie de Duchenne ou l'hémophilie.
4) Rappels de génétique
Les chromosomes sont les éléments situés dans les noyaux des cellules et sont formés par une longue molécule, l'ADN (acide désoxyribonucléique).
L'ADN est composée d'un grand nombre de parties unitaires, les gènes, qui vont fabriquer les protéines destinées aux fonctionnement de l'organisme. On assiste là à une 'expression' des gènes. On peut dire, schématiquement (et de façon fausse), qu'il y a un gène qui est responsable de la couleur des yeux, un autre qui est responsable de la taille de l'individu...
Il y a ainsi entre 50.000 et 100.000 gènes qui dirigent l'organisme.
Les gènes sont formés d'un assemblage d'éléments placés côté à côte, appelés nucléotides formés d'un sucre à 5 atomes de carbone, le désoxyribose, d'un groupement de phosphate et d'une base azotée parmis les quatre possibles : adénine, guanine, thymine et cytosine. Ces bases azotées sont complémentaires deux à deux et reliées par des liaisons faibles hydrogènes. Elle se relient ainsi: adénine-thymine et cytosine-guanine.

Un gène : un fragment d'ADN
Le génotype (ensemble des gènes) de chacun de nous correspond à un phénotype (taille, couleur des yeux...).
5) Buts de la thérapie génique
La thérapie génique va essayer de modifier les gènes qui sont déficients et fonctionnent mal. Il faut donc agir au sein de chaque cellule malade sans altérer les cellules saines. Le but recherché, complexe à atteindre, est donc la modification de la production des protéines.
Pour cela il faut :
- connaître les gènes responsables de la maladie. On réalise un séquençage de l'ADN, c'est à dire une étude des nucléotides qui la composent (génomique structurale, informationnelle et fonctionnelle). L'étude de l'emplacement des gènes permet de savoir où se trouve la zone responsable de la pathologie.
- créer un gène sain en synthétisant une chaine de nucléotide
- incorporer cette chaine dans un vecteur viral ou non-viral
- sélectionner avec précision les cellules cibles qui devront permettre l'entrée du gène
- introduire le vecteur avec le gène dans la cellule
- lui éviter d'être détruit dans le cytoplasme par les enzymes, les lysosomes
- lui permettre de passser dans le noyau cellulaire
- l'incorporer dans le génome de la cellule
- faire en sorte que le gène soit 'exprimé', et qu'il permette la synthèse de la protéine saine, en quantité suffisante
- espèrer une action pérenne et éviter les effets secondaires
6) Les vecteurs
Pour aller modifier les gènes des cellules, il faut utiliser des vecteurs dont le rôle est d'apporter le transgène nécessaire aux cellules. Une nouvelle science émerge actuellement, la vectorologie.
On décrit deux types de vecteurs:
- Les virus qui ont la capacité de pénétrer les cellules et de mélanger leur matériel génétique avec celui des cellules. Ce sont donc de bons candidats vecteurs, mais il y a différentes difficultés qu'il faut surmonter. La virulence du virus doit d'abord être très atténuée pour ne pas rendre malade le patient, et il faut aussi diminuer les réactions immunitaires qui vont s'attaquer au virus. Il faut donc baisser autant que possible son pouvoir antigénique pour éviter les réaction immunologiques (formation d'anticorps, mobilisation des lymphocytes, activation du complément...).
Les virus ont l'habitude de s'adresser à un grand nombre de types cellulaires, alors que nous désirons que le virus n'infecte qu'un type de cellule (respiratoire par exemple). Les chercheurs essayent donc de mettre au point des technique qui modifient la surface du virus pour que les antigènes de surface s'accordent avec les cellules cibles (respiratoires par exemple) et n'aillent pas pénétrer d'autres cellules. On utilise surtout des rétrovirus et moins souvent des adénovirus ou le virus adéno-associé. - Les vecteurs synthétiques, à base d'ADN, de protéines, de lipides ou de polymères cationiques n'ont pas de risque de virulence puisque ce sont des particules inertes. Des inconvénients existent, principalement un problème d'efficacité : il faut au moins 100.000 molécules d'ADN par cellule cible pour qu'une seule séquence parvienne à pénétrer dans le noyau. A cette concentration commencent à se poser des problèmes de toxicité. Ensuite, il faut que l'ADN soit libéré de son vecteur.
L'ADN étant une molécule polyanionique, donc négative, elle a du mal à traverser la paroi des cellules qui est formée de molécules lipidiques négatives. Dans la nature on assiste à une compaction de l'ADN par des molécules composées d'acides aminés chargés positivement comme les histones, qui sont donc chargées de condenser l'ADN.
Une solution élégante sera peut-être la création de chromosomes artificiels humains et déjà diverses équipes travaillent sur ce projet. Cela permettrait une meilleure expression du gène qui serait alors contrôlé par ses propres séquences régulatrices.
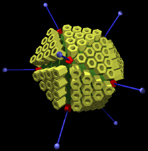 adénovirus (icosahèdre à 252 capsomères) réalisation ophtalmo.net |
 rétrovirus réalisation ophtalmo.net |
7) Les maladies génétiques ophtalmologiques
Différentes pathologies sont consécutives à des dysfonctionnements génétiques; on a ainsi répertorié 240 gènes responsables de maladies de la vision.
- Certains glaucomes, familiaux, sont dus à une altération du gène GLC1A du chromosome 1q, qui code pour la protéine TIGR (Trabecular meshwork Inducible Glucocorticoid Response protein). On a retrouvé cette molécule dans certains photorécepteurs où elle est nommée MYOC (myociline). On retrouve dans différentes études des pressions intra-oculaires très élevées pour ces groupes de patients avec une sévérité importantes des atteintes du nerf optique. On connaît une famille de plus de 1000 personnes qui possèdent une mutation spécifique Asn473Lys dans le troisième exon du gène. Des tests biologiques permettent de savoir si les sujets sont prédisposés, mais cela entraîne des problèmes de coûts et d'éthique.
- Les protéines du cristallin appelées cristallines peuvent être affectées par des mutations et entraîner des cataractes, comme par exemple la cataracte polaire antérieure due à une altération du gène 17p13.
- Les opacités de la cornée appelées dystrophies cornéennes sont souvent en rapport avec une mutation génétique. Ainsi on décrit le gène BIGH3 dont les différentes mutations (R124L, P501T...) vont être responsables d'aspects phénotypiques variés (dystrophie de Reis-Bücklers, dystrophie grillagée, dystrophie granulaire...).
- Les rétinopathie pigmentaires : ces maladies associent un fond d'oeil typique avec la présence de pigment (ostéoblastes), de vaisseaux atrophiques et une papille pâle, à des signes cliniques typiques : héméralopie (vision quasi nulle quand vient le soir), réduction du champ visuel qui devient en 'canon de fusil' puis cécité. Ce groupe de maladies correspond à une grande diversité génétique. Ainsi on a mis en évidence plus de cent gènes responsables.
- Les maladies rétiniennes de l'enfant :
- L'amaurose congénitale de Leber : Cette maladie de l'enfant, qui associe une cécité à des signes ophtalmologiques constants (fond d'oeil normal, nystagmus pendulaire...) semble recouvrir différents aspects génotypiques. Ainsi on décrit les mutations 17p13.1 du gène LCA1 qui rendent les photorécepteurs incapable de revenir à l'obscurité, et les mutations du gène RPE65 situé en 1p31, qui au contraire conduisent à une situation de photorécepteurs toujours dans le noir. Voir l'expérimentation de Acland.
- La maladie de Stargardt : elle associe une baisse très importante de l'acuité visuelle vers 7-12 ans à des aspects variés du fond d'oeil. Le gène ABCR (ABC Retinal) localisé en 1p22.1 est là porteur de différentes mutations qui vont donner des aspects phénotypiques différents. En fonction du type de mutation (mutation faux-sens ou mutations tronquantes) on aura des patients qui présenteront soit un Fundus flavimaculatus, soit un Stargardt, soit une Rétinopathie Pigmentaire. Cette étude montre qu'on ne peut pas associer un gène à une maladie, mais plutôt une mutation d'un gène à un phénotype.
- Le syndrome de Usher 1A : l'aspect du patient est typique et associe une rétinopathie pigmentaire et une surdité. Différentes mutations génétiques sont responsables de cet état clinique uniforme (celles des gènes US1A, US1B, US1C, US1D, US1E). Ces gènes semblent coder pour différentes molécules de type myosine.
- Les DMLA (dégénérescences maculaires liées à l'âge). Il semble que plusieurs gènes, non encore identifiés, soient responsable de ce type de maladie, sans oublier que des facteurs de risque existent (tabac, hypercholestérolémie, soleil, iris clair). On a pu proposer le gène ABCR déjà vu, comme facteurs prédisposant. Par ailleurs il y a sans doute des gènes 'protecteurs' qui vont protéger les patients de cette affection, comme l'allèle epsilon 4 de l'apolipoprotéine E.
8) Difficultés
On se rend compte qu'on ne peut pas associer un gène à une maladie. On vient de voir qu'on peut avoir une maladie qui correspond à de nombreux gènes, ou bien au contraire qu'un seul gène peut donner différentes maladies en fonction de ses mutations ou de son expression.
Tout ceci ne doit pas démoraliser les patients qui attendent avec angoisse les progrès de la biologie moléculaire, mais il faut prendre conscience de la grande difficulté des études et des complications que cela entraîne pour le diagnostic prénatal des maladies ou la thérapie génique des pathologies.
Le diagnostic prénatal en ophtalmologie est difficile et la consultation de conseil génétique permettra dans une premier temps d'étudier toute la parentèle connue.
On demandera parfois un caryotype (syndrome polymalformatif) et plus rarement une étude biomoléculaire pour mettre en évidence des anomalies génétiques. Ainsi il faudra rechercher une délétion du chromosome 11 en cas d'aniridie car il y a prédisposition au néphroblastome (voir la génétique de l'embryologie).
Ces tests qui font quasiment partie de la Recherche doivent être faits avec parcimonie à cause de l'hétérogénéité génétique qui rend les conclusions délicates.
9) La réalité de la thérapie génique
- Janvier 2003 Un deuxième enfant du programme de thérapie génique pour le traitement des "bébés-bulle", dépourvus de défenses immunitaires et obligés de vivre en milieu stérile, a développé "très récemment" une maladie similaire à la leucémie, a annoncé le 15 janvier 2003 l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS).
L'essai sur des patients souffrant du Déficit immunitaire combiné sévère (SCID), une maladie mortelle, à l'hôpital Necker-Enfants malades de l'Assistance publique-Hôpitaux de Paris (AP-HP), avait été suspendu en octobre dernier, trois ans après son démarrage, un premier enfant ayant développé des symptômes similaires à ceux du second. Depuis, les huit patients faisaient l'objet d'une surveillance clinique et biologique renforcée.
Dans le premier cas, la maladie s'est déclarée alors que l'enfant âgé de trois ans avait été traité à l'âge d'un mois. Dans le deuxième, on sait seulement que l'enfant avait aussi été traité quand il était bébé et a développé le cancer presque trois ans plus tard.
Un traitement par chimiothérapie a été entrepris pour les deux enfants, avec "une réponse thérapeutique satisfaisante", précise l'AFSSAPS dans un communiqué.
Par ailleurs, "des investigations similaires à celles réalisées pour le premier enfant ont été immédiatement entreprises pour une meilleure compréhension de la nature de cette complication, afin de développer des méthodes susceptibles de prévenir ce risque", précise l'agence.
Les Etats-Unis suspendent le 14 janvier 2003 une trentaine d'essais thérapies géniques en cours à la suite de la deuxième complication du jeune Français. Par mesure de précaution, la FDA a suspendu "tous essais de thérapie génique utilisant des vecteurs rétroviraux pour introduire des gènes dans les cellules souches du sang", a précisé l'agence fédérale.La FDA a pris cette décision après avoir appris qu'un deuxième enfant traité en France avait développé une maladie semblable à la leucémie, alors qu'il avait jusqu'à présent été traité avec succès contre le déficit immunitaire, une maladie qui force ces enfants à vivre sous environnement stérile, d'où leur nom de bébés-bulle.
Cet essai de thérapie génique était conduit depuis 1999 à l'hôpital Necker à Paris sur 11 enfants souffrant de cette maladie. En octobre dernier, l'essai avait été interrompu par l'Agence française sécurité sanitaire des produits de santé après le premier cas de maladie similaire à la leucémie parmi les enfants traités. Cette thérapie génique avait pourtant fonctionné pendant trois ans, permettant aux enfants de quitter l'hôpital et de mener une vie relativement normale, selon la FDA. Les autorités sanitaires américaines n'ont pour leur part répertorié aucun cas de maladie similaire à la leucémie chez des patients prenant part à des essais de thérapie génique.
- Octobre 2002 Survenue d'une complication chez un des enfant traités.
Une complication est survenue chez un patient (le quatrième) traité en octobre 1999. On a détecté au printemps 2002 un excès d'une population particulière de lymphocytes T dans le sang de l'enfant. Le nombre de lymphocytes est devenu très important à la fin du mois d'août 2002, responsable de signes cliniques, bien que l'enfant soit resté en excellent état général. L'analyse de ces cellules indique leur nature monoclonale et le fait que l'insertion du provirus (copie d'ADN du matériel génétique du virus vecteur utilisé) dans le génome a provoqué la dérégulation du contrôle de l'expression d'un gène cellulaire. Cette dérégulation est sans doute impliquée dans la prolifération de ce clone.
Cette complication est appelée mutagénèse insertionnelle et sa survenue semblait improbable. - Avril 2002: Une équipe londonienne du Great Ormond Street Hospital for Children a annoncé, le 3 avril 2002, qu'elle avai traité par thérapie génique un enfant-bulle qui souffrait d'un déficit immunitaire combiné sévère (DICS). Cette pathologie, portée par le chromosome X, entraîne des infections multiples imposant un confinement de l'enfant dans une bulle stérile.
- Mai 2001: première publication d'un succès de thérapie génique chez l'animal
- Avril 2000 : une équipe médicale française de l'hôpital Necker à Paris vient d'annoncer que deux enfants-bulles sont sortis de leur isolement grâce à une thérapeutique génique. Ces deux jeunes patients de 8 et 11 mois étaient atteints d'un déficit immunitaire combiné sévère lié à l'X (SCID-X1). Ce déficit est lié au blocage de la différenciation des cellules T et NK; il est dû à une anomalie d'un gène porté par l'X qui code une sous-unité (gamma-c) commune aux récepteurs des interleukines 2,4, 7, 9 et 15 responsables de la stimulation de la prolifération et de la différenciation des progéniteurs lymphoïdes.
On a effectué un transfert du gène par un vecteur rétro-viral dans des cellules CD34+ qui ont été prélevées, modifiées, cultivées trois jours et réinjectées. Les enfants sont rentrés chez eux après 90 et 95 jours d'isolement. Le gène transféré s'exprime fonctionnellement, l'inconnue étant la durée de cette restauration immunologique.
M.Cavazzana-Calvo et coll. "Science" vol 288, 28 avril 2000. - Décembre 1999 La presse a annoncé le succès de l'unité Inserm U429 il y a peu de temps (décembre 99), la réussite d'une thérapie génique sur des 'enfants bulles' porteurs d'un grave déficit immunitaire combiné lié au chromosome X, ce qui leur imposait une vie en atmosphère stérile. Le gène responsable nommé gamma-c code pour un récepteur de substances nécessaires au développement des lymphocytes T et NK (Natural Killers).
Après une ponction de moelle et le traitement des cellules souches ex vivo, on a réinjecté les cellules aux jeunes patients. L'incorporation du gène entraîne une telle prééminence des cellules qui en ont bénéficié, que celles-ci deviennent plus nombreuses que les cellules d'origine et entraînent l'émergence d'une nouvelle population de cellules. On ne sait pas si ces dernières cellules sont des cellules souches, ce qui entraînerait une 'guérison' définitive des enfants, ou bien si ce sont des cellules immunitaires spécialisées, ce qui nécessiterait des traitements itératifs. Les prochains mois permettront de répondre à ces questions. La publication officielle ne devrait pas tarder.
10) Futur
Actuellement les recherches s'orientent vers un traitement des cellules somatiques du patient, celles qui composent les organes par exemple. Si on arrive à traiter un patient cela n'aura aucune influence sur sa progéniture.
Une autre voie de recherche est la modification des cellules germinatives qui sont à l'origine des cellules sexuelles, spermatozoïdes et ovules. Dans ce cas on peut penser que la modification concernera la descendance du patient qui exprimera le transgène.
Un autre axe de recherche est la mise en oeuvre des oligonucléotides chimériques qui sont formés par une association d'un brin d'ADN et d'un brin d'ARN complémentaires des régions chromosomiques à corriger. Cela permettra sans doute de réparer des mutations ponctuelles de gènes défectueux.
Tous ces éléments doivent être étudiés sous le regard attentif de la Déontologie, de la Bioéthique, du Droit, et de la Médecine.
11) Quelques liens
|
en français : |
en anglais : |
12) Quelques textes
An unnatural base pair for incorporating amino acid analogs into proteins
Ichiro Hirao, Takashi Ohtsuki, Tsuyoshi Fujiwara, Tsuneo Mitsui, Tomoko Yokogawa, Taeko Okuni, Hiroshi Nakayama, Koji Takio, Takashi Yabuki, Takanori Kigawa, Koichiro Kodama, Takashi Yokogawa, Kazuya Nishikawa & Shigeyuki Yokoyama,
Nature biotechnology February 2002 Volume 20 Number 2 pp 177 - 182
Biologie moléculaire et médecine
JC Kaplan et M Delpech
Flammarion médecine-Sciences Paris
Génétique et ophtalmologie
Réflexions ophtalmologiques avril 1999