Le site des ophtalmologistes de France
Encyclopédie de la vue
Vous êtes ici
Toxoplasmose oculaire
Toxoplasmose oculaire
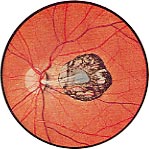
Cicatrice maculaire
Définition
La toxoplasmose est une zoonose (maladie des animaux vertébrés transmissible à l'homme). Cette maladie parasitaire cosmopolite est due à un protozoaire nommé toxoplasme et plus précisemment Toxoplasma Gondii. En raison de sa faible spécificité, cette infection peut atteindre aussi bien l'homme que les animaux homéothermes (qui maintiennent une température constante).
Grâce à la présence d'anticorps, on considère qu'en France 90% des sujets adultes ont rencontré le parasite.
Cette affection est très fréquente et habituellement bénigne. Elle entraîne de graves problèmes chez la femme enceinte (foetopathie) et chez l'immunodéprimé.
Une nouvelle notion permet d'évoquer la gravité de certaines toxoplasmoses acquises qui peuvent parfois donner des lésions oculaires.
Historique
L'histoire retient principalement la découverte de Charles Nicolle et L.Manceaux en 1908 à l'Institut Pasteur de Tunis. A la suite d'une épidémie de laboratoire chez un rongeur, le Gondi , ils isolèrent un protozoaire de forme arquée. Ils nommèrent donc le parasite Toxoplasma Gondii. L'origine grecque du mot vient de toxon (arc) et plasma (forme).
, ils isolèrent un protozoaire de forme arquée. Ils nommèrent donc le parasite Toxoplasma Gondii. L'origine grecque du mot vient de toxon (arc) et plasma (forme).
Cette découverte sera présentée le 26 octobre 1908 par Laveran, à l'Académie des Sciences de Paris.
A peu près au même moment, A.Splendore trouve ce parasite à la suite de la mort de lapins de laboratoire, à Sao Paulo. La publication de ces résultats se fera le 16 juillet 1908.
Parasitologie
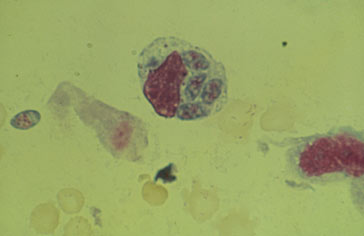 4 Tachyzoïtes intracellulaires |
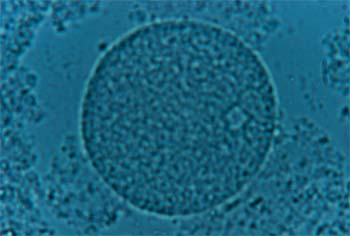 Kyste toxoplasmique |
Clichés dus à l'obligeance du Dr Marie-Hélène Bessières, Laboratoire de Parasitologie et Mycologie, CHU de Rangueil, Toulouse France
Le toxoplasme libre
Il a une forme d'arc avec une extrémité plus effilée, mesure environ 4µm sur 2µm de large et est appelé tachyzoïte. Ce terme vient du grec tachus (rapide) pour évoquer la rapidité de sa division dans les cellules qui l'hébergent. Il peut se déplacer par des mouvements circulaires, ondulatoires ou par rotation. Il peut aussi changer de forme, ce qui a rendu son identification délicate dans les années 1900.
Il ne peut vivre qu'à l'intérieur d'une cellule qu'il parasite. La pénétration peut venir de deux mécanismes : le parasite peut lyser la membrane cellulaire et s'immiscer à l'intérieur de la cellule, ou bien il peut se faire phagocyter.
Le kyste
Lors de réaction de l'organisme, on peut assister à la formation de kystes toxoplasmiques (zoïtokystes) quasiment immobiles. Il ne se divise que très peu et est appelé bradyzoïte (du grec bradus-lent). Lors de conditions favorables, il y a une transformation des bradyzoïtes en tachyzoïtes qui vont se déplacer et coloniser les cellules de l'hôte.
Ces kystes sont très résistants au froid et aux agressions extérieures, ce qui leur permet de survivre et de se transformer quand ils trouvent un hôte accueillant.
Les facteurs de transmission
Le chat

La contamination d'une population dépend étroitement de la fréquence des chats. Ils sont les seuls hôtes définitifs des toxoplasmes, l'homme n'étant qu'un hôte intermédiaire. Les ookystes émis par le chat dans les déjections sont très résistants au froid et subsistent des mois dans la nature. Ils peuvent contaminer des cours d'eau qui seront infestants. L'absorbtion de ces ookystes par l'homme va entraîner une toxoplasmose.
La viande
La consommation de viande contaminée est la principale cause d'infection toxoplasmique. La consommation de viande crue ou insuffisamment cuite, rôtie ou grillée augmente la fréquence de séropositivité.
Clinique
- L'infection toxoplasmique du sujet immunocompétent (normal)
=> C'est très exceptionnellement une maladie grave (quelques sujets dans la littérature). Dans ce cas-là on découvre des lésions cardiaques, pulmonaires, neurologiques. En phase aiguë septicémique le sujet fiévreux transmet des parasites par les larmes, la sueur ou la salive. Le décès peut survenir rapidement.
=> C'est dans 20% des cas une forme subaiguë, avec des adénopathies du cou et de la nuque (ganglions). Le sujet pyrétique présente une augmentation des monocytes sanguins. Ce tableau de lymphadénite ressemble à une mononucléose infectieuse et va guérir progressivement.
=> Dans 80% des cas il s'agit d'une forme inapparente car le patient n'a pas de fièvre, mais seulement des adénopathies du cou pendant une huitaine de jours. Il ne s'en souviendra souvent pas.
- L'infection foetale
En cours de grossesse le placenta peut être contaminé. Plus l'infection du foetus est tardive et plus tard les symptômes cliniques se manifestent. Sur 800000 grossesses annuelles, 2000 femmes feront une toxoplasmose et 700 foetus seront contaminés. Une sérologie est obligatoire en prénuptial.
=> La toxoplasmose congénitale grave entraîne des calcifications intracrâniennes pathognomoniques (caractéristiques). Il s'y ajoute souvent un crâne augmenté de volume, une dilatation ventriculaire, des perturbations neurologiques (convulsions, hypotonie) et des anomalies oculaires graves. On retrouve en effet une choriorétinite toxoplasmique uni ou bilatérale qui peut siéger sur la macula et rendre l'enfant quasiment aveugle. Les formes les plus graves entraînent la mort du foetus.
=> La toxoplasmose viscérale, moins grave, atteint malgré tout le foie et entraîne un ictère néo-natal associé parfois à des troubles hématologiques.
=> La toxoplasmose congénitale moins sévère, avec des lésions oculaires immédiates ou survenant plus tardivement chez l'enfant. Ce décalage entre l'infection et la découverte d'une choriorétinite toxoplasmique est fréquent.
- Chez l'immunodéprimé
Que ce soit dans le cadre du sida ou bien dans le temps post-opératoire des transplantés et greffés, on va assiste à une toxoplasmose souvent grave avec prolifération de tachyzoïtes.
Nouvelles notions de la toxoplasmose acquise
On a longtemps considéré que les lésions oculaires survenaient à la suite de toxoplasmoses congénitales contractées in utero.
En fait quelques rares auteurs ont décrit des lésions oculaires après des foyers régionaux de toxoplasmose dus à une contamination de l'eau ou des aliments.
C'est ce qui s'est passé dans le sud du Brésil, ainsi qu'en Colombie britannique entre 1994 et 1995. On a vu des séries de chorio-rétinites toxoplasmiques après contamination de ces populations. Le dogme de la contamination in utero a donc été remis en question.
Les lésions oculaires
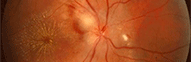
Les lésions oculaires sont généralement faciles à reconnaitre mais il existe des formes cliniques qui peuvent égarer le diagnostic. Classiquement on découvre une lésion jaunâtre (cliché de gauche) qui peut être paramaculaire ou parapapillaire et cette anomalie va évoluer vers une cicatrisation pigmentée comme sur le cliché de droite. Ici la lésion est loin de la macula et n'obère pas le pronostic visuel, mais des localisations plus dangereuses vont nécessiter un traitement adapté.
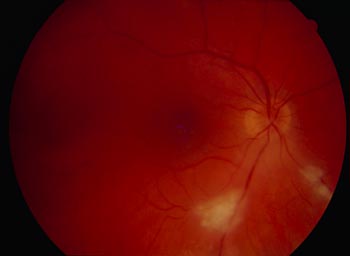 Lésion toxoplasmique récente jaunâtre Photo Pr André Mathis CHU Toulouse-Rangueil France |
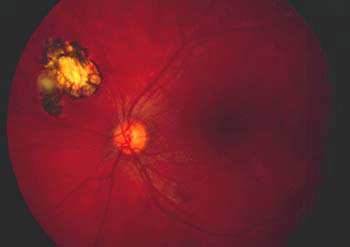 Lésion toxoplasmique cicatricielle périphérique Photo Pr André Mathis CHU Toulouse-Rangueil France |
Le foyer de rétino-choroïdite toxoplasmique aiguë
On découvre un foyer typique à bords flous, jaunâtre, accompagné souvent d'une réaction inflammatoire du vitré et de la chambre antérieure. La découverte de foyers anciens cicatrisés à distance facilite le diagnostic.
Quand le foyer se situe à côté de la papille, on est en face d'une chorio-rétinite juxta-papillaire de Jensen (décrite en 1908) responsable d'une baisse de vision par déficit fasciculaire (lésion des fibres nerveuses qui vont vers le nerf optique). Le champ visuel met en évidence un scotome fasciculaire qui peut s'aggraver sans traitement.
L'angiographie fluorescéïnique montre une lésion hypofluorescente aux temps précoces puis il y a une coloration du foyer par les bords et les temps tardifs correspondent à une diffusion globale du colorant.
Des complications peuvent survenir, comme une papillite, un décollement séreux rétinien, des néovaisseaux prérétiniens ou sous-rétiniens.
L'évolution se fera en quelques semaines vers un foyer pigmenté typique.
Le foyer cicatriciel
Il est souvent découvert par hasard et permet de caractériser l'affection. Une cicatrice maculaire va laisser un oeil quasiment aveugle alors qu'une cicatrice périphérique loin du centre de la vision passsera inaperçue pour le patient.
Une complication est décrite pour ces foyers pigmentés, l'appartion d'une membrane épirétinienne qui va s'étendre sur le pôle postérieur et plisser de plus en plus la rétine. Le sujet verra des images déformées (métamorphopsies). Seul un traitement chirurgical permettra l'ablation de ces membranes très invalidantes.
Diagnostic biologique
Le coefficient C de Desmonts permet d'évaluer la production d'anticorps anti-toxoplasmiques dans l'humeur aqueuse, prélevée par ponction de chambre antérieure (pca).
anticorps antitoxoplasmiques dans l'humeur aqueuse
-------------------------------------------------------------------------
Immunoglobulines totales dans l'humeur aqueuse
C=_________________________________________
anticorps antitoxoplasmiques sériques
----------------------------------------------------
Immunoglobulines totales sériques
Il y a production locale d'anticorps si C est supérieur à 3 et probable entre 2 et 3.
|
Dr Bessières, laboratoire de parasitologie et mycologie, Toulouse-Rangueil (France) : Au niveau du sérum Sérologie de la toxoplasmose sur le sérum : L'absence d'anticorps IgG anti-toxoplasmiques permet d'exclure une toxoplasmose oculaire La présence d'anticorps IgG anti-toxoplasmiques permet d'évoquer une toxoplasmose oculaire : elle est à comparer à la sérologie de l'humeur aqueuse. Il est possible de mettre en évidence une synthèse locale d'anticorps dans l'humeur aqueuse par le calcul des charges immunitaires de l'humeur aqueuse et du sérum. Au niveau de l'humeur aqueuse Sérologie de l'humeur aqueuse : L'absence d'anticorps spécifiques IgG anti-toxoplasmiques ne permet pas d'exclure une toxoplasmose oculaire La mise en évidence d'une synthèse locale d'anticorps IgG dans l'humeur aqueuse est le témoin d'une toxoplasmose oculaire. Il est possible de faire une recherche d'ADN toxoplasmique dans l'humeur aqueuse mais un examen négatif ne permet pas d'exclure une toxoplasmose oculaire. L'association sérologie sur l'humeur aqueuse et recherche d'ADN toxoplasmique améliore le diagnostic de toxoplasmose oculaire. |
Prévention
La femme enceinte et l'immunodéprimé doivent veiller à
- éviter le contact avec les chats et leur litière
- bien se laver les mains avant de passer à table
- bien cuire la viande
- bien laver les aliments crus (salade...)
- une sérologie par mois sera réalisée chez la femme enceinte non immunisée pour déceler toute infection récente
Traitements
La Spiramycine (Rovamycine®) est bien supportée par la femme enceinte.
Le traitement classique associe deux médicaments antiparasitaires :
- la Pyriméthamine (Malocide®) mais cela entraîne une carence en acide folique avec anémie mégaloblastique, et parfois granulopénie et thrombopénie. Pour contrer le déficit en acide folique, on ajoute du folinate de calcium (Lederfoline®) qui s'oppose aux inhibiteurs de la dihydrofolate réductase
- la Sulfadiazine (Adiazine®) qui s'accompagne de risque sévère d'allergie cutanée et de thrombopénie, anémie hémolytique immuno-allergique, aplasie médullaire
Ce traitement redoutablement efficace est redoutablement dangereux et doit être mené avec circonspection (risque de décès....).
Bibliographie
Comme le rappelle le rapport de la Société Française d'Ophtalmololgie, il existe plus de 18000 références bibliographiques. Nous n'en évoquerons que certaines.
Diallo J.S Manifestations ophtalmologiques des parasitoses, Société Française d'Ophtalmologie,Masson, 1985.
Cohen D. Rétino-choroïdite toxoplasmique : formes cliniques, Réalités ophtalmologiques, p5-11, février 1993.
Brézin A, Toxoplasmose oculaire : diagnostic biologique, Réalités ophtalmologiques, p15-17, février 1993.
Glasner PD, Silveira C, Kruszon-Moran D, et al. An unusually hight prevalence of ocular toxoplasmosis in Southern Brazil. Am J Ophthalmol 1992; 114:136-44.
Bowie WR, King AS, Werker DH, et al. Outbreak of toxoplasmosis associated with municipal drinking water. Lancet 1997;350:173-7.
Couvreur J, Thulliez Ph. Toxoplasmose acquise à localisation oculaire ou neurologique. La presse médicale, p438-441, 16 mars1996.
François Jules La toxoplasmose et ses manifestations oculaires. Masson, 1963.