Le site des ophtalmologistes de France
Encyclopédie de la vue
Vous êtes ici
Amaurose congénitale de Leber (thérapie génique)
Amaurose congénitale de Leber
Prospective en thérapie génique
1) Introduction
L'amaurose congénitale de Leber est une maladie familiale grave des yeux, qui est responsable d'une cécité ou d'une malvoyance dès la naissance .Cette maladie est totalement différente de la neuropathie optique héréditaire de Leber dont nous avons parlé dans un chapitre qui lui est dédié.
Un récent article (mai 2001) dans le journal Nature Genetics décrit la thérapie génique de chiens présentant une affection comparable à l'amaurose congénitale de Leber, avec un succès qui semble prometteur.
|
G M Acland, G D Aguirre, J Ray, Q Zhang, T S Aleman, A V Cideciyan, S E Pearce-Kelling, V Anand, Y Zeng, A M Maguire, S G Jacobson, W W Hauswirth & J Bennett Gene therapy restores vision in a canine model of childhood blindness Nature Genetics Volume 28 May 2001 pp 92 - 95.
L'achat de l'article (en anglais) est possible pour 10$ us : |
|
2) Résumé
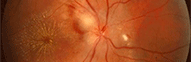
La relation entre les cellules visuelles que sont les cônes et les bâtonnets d'une part et l'épithélium pigmentaire sous-jacent est primordiale pour un bon fonctionnement de la rétine. Lorsque cette relation est altérée, des pathologies très sévères conduisant à la cécité, comme l'amaurose de Leber, peuvent se développer.
Dans l'article, les auteurs rapportent la thérapie génique pratiquée sur un modèle animal (chien) présentant une anomalie de fonctionnement du gène RPE65. Ces chiens constituent un modèle d'une forme particulière de l'amaurose congénitale humaine de Leber de type LCA2 due à des mutations dans ce même gène (OMIM180069 et OMIM204100).
RPE correspond à Retinal Pigment Epithelium.
Les auteurs ont utilisé un adeno-associated virus (AAV) pour transmettre le gène normal RPE65 aux animaux malades qui ont recouvré une certaine vision.
Amaurose de Leber due à des mutations de RPE65
Christian Hamel, Inserm Montpellier France
3) Réalisation
Le gène RPE65 code une protéine du même nom qui intervient dans la synthèse du pigment visuel (rhodopsine), mais dont le rôle précis n'est pas encore déterminé.
Les patients ayant des mutations dans ce gène ont donc un déficit dans la synthèse du pigment visuel, et par conséquent ont des photorécepteurs qui réagissent très peu à la lumière. Il a été montré que chez la souris déficiente en Rpe65, l'apport d'une forme artificielle d'un des composants de ce pigment visuel (le 9-cis-rétinal), permet de retrouver de la vision.
Malheureusement ceci ne peut être envisagé chez l'homme pour l'instant car ce composant s'accumulerait et risquerait d'être préjudiciable à la rétine.
Les chiens homozygotes présentant une mutation des 2 copies de RPE65 vont devenir progressivement aveugles par dégénérescence des photorécepteurs.
In vitro l'équipe a combiné le gène RPE65 normal a un virus AAV, puis a transmis le virus combiné dans la culture de cellules déficientes. L'immunohistochimie a permis de mettre en évidence l'apparition du gène normal dans les cellules malades. Ce gène a été exprimé, donc fonctionnel, ce qui a été vérifié par PCR et western-blot.
In vivo, les auteurs ont administré le virus combiné à trois chiens et ont surveillé l'électrorétinogramme (ERG) pour étudier le fonctionnement de la rétine.
L'injection s'est faite sous la rétine au niveau de l'oeil droit et dans le vitré au niveau de l'oeil gauche.
L'ERG des chiens a mis en évidence une augmentation du tracé et donc un fonctionnement rétinien amélioré de l'oeil droit. L'ERG de l'oeil gauche n'a pas montré d'amélioration.
L'étude a été faite également avec un pupillomètre et on a constaté une meilleure réponse pour les yeux droits traités en injection sous-rétinienne.
Le comportement des chiens a été étudié également et on s'est rendu compte que les chiens traités évitaient les obstacles situés sur leur côté droit; les chiens non traités n'évitaient aucun obstacle.
A 99 jours de l'injection, les yeux ont été étudiés sur le plan histochimique. La PCR a permis de se rendre compte que la rétine exprimait bien le gène sain
Les études précédentes avaient montré que la thérapie génique pouvait retarder la dégénérescence cellulaire mais cette étude-là a permis de retrouver une vision certaine.
4) L'avenir
Il faudra de nombreuses autres études avant de pouvoir tenter de traiter les patients porteurs d'amaurose congénitale de Leber. Mais il s'agit là d'une voie nouvelle porteuse d'espoir.
5) Sites web et contacts
Retina International's Scientific Newsletter : Tout sur la protéine RPE65 (en anglais)
RPE65-T. Michael Redmond National Eye Institute
En France:
Dr C. Hamel (hamel@montp.inserm.fr) ou Dr J. Kaplan (kaplan@necker.fr)
6) Bibliographie succinte
Acland G M , Aguirre G D , Ray J, Zhang Q , Aleman T S , Cideciyan A V , Pearce-Kelling S E , Anand V , Zeng Y , Maguire A M , Jacobson S G , Hauswirth W W & Bennett J Gene therapy restores vision in a canine model of childhood blindness Nature Genetics Volume 28, May 2001, pp 92 - 95.
Aguirre, G. D.; Baldwin, V.; Pearce-Kelling, S.; Narfstrom, K.; Ray, K.; Acland, G. M. : Congenital stationary night blindness in the dog: common mutation in the RPE65 gene indicates founder effect. Molec. Vision 4: 23, 1998.
Gu, S.; Thompson, D. A.; Srikumari, C. R. S.; Lorenz, B.; Finckh, U.; Nicoletti, A.; Murthy, K. R.; Rathmann, M.; Kumaramanickavel, G.; Denton, M. J.; Gal, A. : Mutations in RPE65 cause autosomal recessive childhood-onset severe retinal dystrophy. Nature Genet. 17: 194-197, 1997
Hamel, C.P., Jenkins, N.A., Gilbert, D.J., Copeland, N.G., and Redmond, T.M. The gene for the retinal pigment epithelium-specific protein RPE65 is localized to human 1p31 and mouse 3. 1994; Genomics. 20: 509-512.
Marlhens, F., Bareil, C., Griffoin, J.M., Zrenner, E., Amalric, P., Eliaou, C., Liu, S.Y., Harris, E., Redmond,T.M., Arnaud, B., Claustres, M., and Hamel, C.P. Mutations in RPE65 cause Lebers congenital amaurosis. 1997; Nat.Genet. 17: 139-141.
Morimura, H.; Fishman, G. A.; Grover, S. A.; Fulton, A. B.; Berson, E. L.; Dryja, T. P. : Mutations in the RPE65 gene in patients with autosomal recessive retinitis pigmentosa or Leber congenital amaurosis. Proc. Nat. Acad. Sci. 95: 3088-3093, 1998.
Nicoletti, A., Kawase, K., and Thompson, D.A. Promoter analysis of RPE65, the gene encoding a 61-kDa retinal pigment epithelium-specific protein. 1998; Invest.Ophthalmol.Vis.Sci. 39: 637-644.
Nicoletti, A., Swain, P.K., Swaroop, A., and Thompson, D.A. Regulation of Gene Expression In The Retinal Pigment Epithelium: NRL Enhances Transcription From The RPE65 Promoter. 1998; Invest.Ophthalmol.Vis.Sci. 39: S197
Redmond, T. M.; Yu, S.; Lee, E.; Bok, D.; Hamasaki, D.; Chen, N.; Goletz, P.; Ma, J.-X.; Crouch, R. K.; Pfeifer, K. : Rpe65 is necessary for production of 11-cis-vitamin A in the retinal visual cycle. Nature Genet. 20: 344-351, 1998.