Le site des ophtalmologistes de France
Encyclopédie de la vue
Vous êtes ici
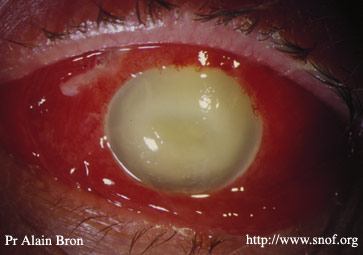
Prévention et clinique de l'endophtalmie
Prévention et clinique de l'endophtalmie
Bases épidémiologiques de la prévention
et du traitement de l'endophtalmie
Observatoire National Des Endophtalmies
O.N.D.E
Dr Annie Salvanet-Bouccara
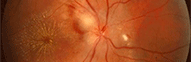
Endophtalmie secondaire à une trabéculectomie
Introduction
Bien que l’incidence de l’endophtalmie post-opératoire ait considérablement diminué comme l’a confirmé l’étude prospective multicentrique française (étude G.E.E.P. incidence 0,3 %) du fait des précautions d’asepsie, et des nouvelles techniques de chirurgie à pression positive, la contamination per-opératoire n’a pas pu être totalement éliminée et l’endophtalmie reste une complication imprévisible, risque infectieux hypothétique mais précis.
Cette complication imprévisible est devenue juridiquement indésirable car l'endophtalmie rentre dans le champ des infections nosocomiales définies comme toute maladie provoquée par des micro-organismes, contractée dans un établissement de soins par tout patient après son admission, soit pour hospitalisation, soit pour y recevoir des soins ambulatoires ; que les symptômes apparaissent lors du séjour à l'hôpital ou après ; que l'infection soit reconnaissable aux plans clinique ou microbiologique, données sérologiques comprises, ou encore les deux à la fois.
Ce concept d'infection nosocomiale est fondamental puisque qu'en matière d'infection nosocomiale le médecin est tenu vis à vis de son patient d'une obligation de sécurité, de résultat dont il ne peut se libérer qu'en rapportant la preuve d'une cause étrangère.
I) Considérations épidémilogiques préalables aux mesures prophylactiques et thérapeutiques
La connaissance des germes responsables d'endophtalmie et leur sensibilité aux antibiotiques, l'origine des germes, les diverses sources de contamination seront les considérations qui nous permettront d'étayer notre réflexion afin de mettre en œuvre des mesures prophylactiques et thérapeutiques rationnelles.
I - 1 - 1) La nature des germes responsables d'endophtalmie et leur sensibilité aux antibiotiques
De nombreuses études rétrospectives ont montré que des germes très variés pouvaient être responsables d’endophtalmies (Eichenbaum 1970, Allen 1974, Peyman 1978 et 1980, Forster 1976 et 1980, Diamond 1980, Harris 1982, Rowey et Puliafito 1982, Olson 1983, Bohijian 1984, Driebe et Weber 1986…).
Dans ces dix dernières années, deux études multicentriques prospectives ont permis de montrer la prédominance des germes Gram positif.
En 1989, pour le G.E.E.P. (Groupement d’Etudes Epidémiologiques et Prophylactiques), les prélèvements endoculaires ont été pratiqués dans 61,5 % des endophtalmies post-chirurgicales et ont permis d’isoler chez le pseudophake 20 germes soit 85 % de bactéries à Gram positif (BGP), comprenant 50 % de Staphylococcus epidermidis, 5 % de Staphylococcus aureus et 30 % de Streptococcus, et 15 % de bactéries à Gram négatif (BGN).
Au cours de l'EVS (de 1990 à 1994 Endophthalmitis Vitrectomy Study), les 420 patients inclus ont subi conjointement un prélèvement d’humeur aqueuse et de vitré. Les cultures ont été positives dans 69,3 % des cas. Des BGP ont été isolés dans 94,2 % de ces cas comprenant 70 % de Staphylococcus epidermidis et 24,2 % d’autres espèces à Gram positif. Ce dernier groupe (74 cultures) comprenait 32 cultures soit 9,9 % de Staphylococcus aureus, 29 cultures soit 9,0 % de Streptococcus, 7 cultures soit 2,2 % d’Enterococcus. Les BGN étaient moins fréquents (19 cultures soit 5,9 %).
A noter, qu’aucun germe d’origine fongique n’a été isolé.
Ainsi, ces deux études permettaient de montrer une similitude microbiologique de la chirurgie prothétique ophtalmologique avec les autres chirurgies prothétiques.
I - 1 - 2 ) Sensibilité des germes responsables d’endophtalmies aux antibiotiques :
Les germes isolés au cours de l’EVS ont été testés pour l’Amikacine, la Vancomycine, la Ceftazidime, l’Oxacilline et la Ciprofloxacine.
Ainsi, 100 % des BGP sont sensibles à la Vancomycine. Les Staphylococcus Epidermidis sont tous sensibles à la Vancomycine, 86,1 % d’entre-eux le sont à l’Amikacine, 77,9 % le sont à la Ciprofloxacine, 62,7 % le sont à l’Oxacilline et 62,1 % à la Ceftazidime.
Il en est de même pour Staphylococcus aureus : 100 % d’entre eux sont sensibles à la Vancomycine ; 81,3 % à l’Amikacine et à la Ciprofloxacine ; 78,6 % à l’Ofloxacine et 77,4 % à la Ceftazidime.
Les Enterococcus testés étaient tous sensibles à la Vancomycine. Les Streptococcus pneumoniae testés étaient tous sensibles à la Ceftazidime et à la Vancomycine.
Quant aux BGN, 89,5 % étaient sensibles à l’Amikacine ainsi qu’à la Ceftazidime.
I - 2 ) L'origine des germes et les sources de contamination
Les sources de contamination soient extrêmement variées, ainsi que l’ont montré Allen et Mangaricine (contamination d’origine aérienne, contamination due aux tissus environnants le patient, contamination par le matériel de bloc et contamination par les solutés et les médicaments irrigués dans l’œil).
Les études bactériologiques écologiques des germes pathogènes présents dans le cul-de-sac conjonctival montrent des résultats similaires aux bactéries responsables d'endophtalmie : 78 % de B.G.P. (S. aureus 36,6 , Streptococcus 56,8 %, S. pneumoniae 6,5 %) et 22 % de B.G.N. (Haemophilus 6,82 %, Proteus 32,4 %, Pseudomonas 5,68 %, Klebsiella 15,9%) (étude S. Liotet Thèse X. Dezard).
M.G. Speaker a, le premier, montré l’importance de certains représentants de la flore bactérienne opportuniste ou pathogène du cul-de-sac conjonctival du patient qui pénétreraient dans l’œil au moment de l’acte chirurgical, et seraient à l’origine de la majorité des endophtalmies. En 1991, cet auteur grâce à l’analyse bactériologique génétique des germes responsables d’endophtalmies, a montré une similitude entre la bactérie isolée dans le vitré et l’humeur aqueuse et celles isolées au niveau d’un prélèvement externe (cul-de-sac conjonctival et narines) dans 14 cas sur 17. Il en conclut donc que la bactérie infectante provenait du patient lui-même et avait été introduite dans la chambre antérieure au moment de l’acte chirurgical.
Poursuivant cet axe de recherche sur les souches isolées au cours de l’EVS, Bannerman, Dwayne et col, ont montré grâce à l’électrophorèse en champ pulsé l’analogie entre les différents Staphylocoques à coagulase négative, responsables d’endophtalmies, et ceux du cul-de-sac conjonctival, dans 71 cas parmi 105 endophtalmies à S. coagulase négative soit 67,7 % des cas étudiés.
On se gardera, bien entendu, de généraliser, car si toutes les sources de contamination sont bien connues, leur identification avec certitude reste difficile en présence d’une endophtalmie déclarée. Il n’en reste pas moins que les travaux de Speaker, confirmés par l’EVS, sont une avancée scientifique fondamentale dans la compréhension du rôle des Staphylocoques à coagulase négative, au cours de l’endophtalmie.
Cependant, les trois autres sources de contamination (aérienne, par le matériel du bloc opératoire, par les solutés divers) peuvent être soupçonnées lors de contamination par germes très virulents (Pseudomonas) ou de nature fongique. Elles peuvent donner lieu à des "micro-épidémies" pour lesquelles une enquête faisant appel à des équipes pluridisciplinaires d'hygiènistes, microbiologistes, d'infectiologues est nécessaire, justifiant pleinement le rôle des CLIN (Comité de Lutte contre les Infections) au sein des établissements de santé. Ainsi, Zaluski a décrit des endophtalmies à Pseudomonas aerugionosa à partir des circuits contaminés de phacoémulsificateurs. Neuman, quant à lui, a décrit une épidémie d'endophtalmie à candida, due à la contamination de solutions irrigatrices.
Ces résultats n’expliquent cependant pas la faible incidence de l’endophtalmie en chirurgie ophtalmologique.
Dans ces conditions, quelle doit être l’importance de l’inoculum ?. Quelle doit être la densité bactérienne sur les tissus externes ?. L'étude qualitative de S. Liotet, citée en référence ci-dessus, sur les germes du cul-de-sac conjonctival aborde le problème de la "densité" des germes retrouvés. Cette notion quantitative est un des points essentiels, ainsi que les variations de la flore conjonctivale dans le temps. Pour être complète, l'étude de cette microbiologie de surface devrait nous apporter une connaissance qualitative quantitative et cinétique. Nos études nous permettent-elles de connaître le germe le plus fréquent ou le germe le plus virulent. On entrevoit la complexité de telles études.
L’humeur aqueuse est en effet capable de stériliser certains inoculum comme en témoigne l’étude expérimentale d’endophtalmies à Staphylococcus epidermidis chez le lapin menée par Meredith et les diverses études du liquide de fin d’intervention (LEFI) chez l’homme. Suivant les divers auteurs de 5 à 25 % de LEFI sont contaminés ; or, l’incidence de l’endophtalmie suivant les études n’est que de 0,3 % à 0,03 %.
Par ailleurs, l’adhésion plus importante de germes de type Staphylococcus epidermidis ou Propionibacterium acnes varie selon le biomatériau composant la lentille intra-oculaire, et pourraient être à l’origine d’endophtalmie. Dans une étude in vitro, C. Burillon retrouve un nombre de bactéries similaires sur le PMMA, le silicone et l'acrylique, tandis que l'adhésion bactérienne sur le matériau hydrogel est diminuée de façon significative. Ainsi, la diminution progressive du polyméthyl méthacrylate, au profil de nouveaux matériaux moins hydrophobique, avec des surfaces mieux finies, permettant le pliage de l'implant, protégeant ainsi sa face postérieure de l'adhésion bactérienne permettent de diminuer l'adhérence bactérienne source d'endophtalmie aiguë (niveau 1 de l'adhérence du SCN non producteur de slime) et chronique (niveau 2 de l'adhérence du SCN producteur de slime). C’est pourquoi, certains traitements de surface ont été proposés en vue d’une moindre adhérence des germes lors de l’introduction de l’implant.
A priori les virus n'entraînent pas de contamination directe intra-oculaire.
Les ATNC (agents transmissibles non conventionnels) représentent un risque théorique, non évaluable en pratique. Un cas de transmission de Creutzfeldt Jakob a été rapporté après une greffe de cornée.
Prévention des endophtalmies post-opératoires
Les mesures prophylactiques visent toutes à éliminer les germes responsables de l'infection post-opératoire.
Le code de déontologie impose aux médecins : "notamment de veiller à la stérilisation et à la décontamination des dispositifs médicaux qu'il utilise […]. Il ne doit pas exercer sa profession dans des conditions qui puissent compromettre la qualité des soins et des actes médicaux ou la sécurité des personnes examinées. Il doit veiller à la compétence des personnes qui lui apportent leur concours". Cette disposition trouve à s'appliquer quel que soit votre statut. Il souligne l'importance de la gestion et de l'organisation impliquant des professionnels nombreux et différents. Ainsi pour J. CARLET, Président du Comité Technique National des Infections Nosocomiales, les infections hospitalières sont rarement liées à notre époque à une faute technique grossière et unique, mais plutôt à un ensemble de dysfonctionnements, d'erreurs de gestion et d'organisation impliquant de nombreux professionnels différents. Nous nous trouvons de ce fait dans une situation très difficile.
L'antisepsie vise à diminuer le nombre de germes autour de l'oeil.
L'antibioprophylaxie viserait à tuer les germes introduits dans l'oeil au cours de l'acte opératoire.
II -1) Les logiques d'asepsie et péri-environnementales:
Comportent les logiques d'accompagnement péri-opératoires de diminution des risques d'inoculation bactérienne :
Logique péri-environnementale du patient :
L'examen pré-opératoire doit dépister les facteurs de risques liés au patient lui-même :
- malnutrition, obésité,
- diabète,
- insuffisant respiratoire,
- infections à distance du site opératoire,
- infections oculaires pré-éxistantes (conjonctivites, blépharites, VL, œil sec…)
Logique pré-opératoire :
- hospitalisation pré-opératoire réduite,
- éliminer les colonies de staphylocoques nasales, enlever les lentilles de contact,
- mesures générales d'hygiène (douche, shampooing),
- une antibiothérapie préalable accroîtrait le risque infectieux en sélectionnant des germes résistants aux antibiotiques
Logique per-opératoire :
- le bloc opératoire et le personnel : elles comportent le respect des règles d'hygiène régissant l'environnement chirurgical (air de salle d'opération, contrôle de l'eau, décontamination de la salle d'opération, respect des règles de circulation en salle d'opération, respect des circuits en particulier pour les blocs multidisciplinaires, intérêt des hospitalisations très courtes (ambulatoire))…Elles sont régies par de nombreux textes de référence.
Les règles du nettoyage de décontamination et de stérilisation (134° pendant 18 minutes) des instruments doivent strictement mis en œuvre et connus du chirurgien. La circulaire 100 expose les précautions à prendre pour la chirurgie ophtalmologique classée par l'OMS en catégorie I à haute infectiosité : tout patient d'ophtalmologie doit être considéré comme ayant un risque virtuel d'être infecté par un ATNC. Le problème est donc de repérer les patients au cours de la consultation pré opératoire et pré anesthésique. Pratiquement prévoir double procédure et/ou une boîte réservée aux patients à risque (traitement par hormones extractives hypophysaires, antécédent d'intervention neurochirurgicale, patient dont le père, la mère, le frère ou la sœur est infecté par un ATNC soit patient ayant une infection par ATNC diagnostiquée ou suspectée).
Tous les chirurgiens sont confrontés à la difficulté du nettoyage du microscope. L'intérêt du matériel jetable est évident : le médecin réutilisant du matériel jetable est juridiquement condamnable.
Le chirurgien introduit en per-opératoire dans l'œil des instruments, des solutions irrigatrices, des médicaments (visco-élastiques, myotique voire antibiotique), des matériels prothétiques. Chacun de ces éléments peut être à l'origine d'une contamination. Ainsi la contamination par la solution irrigatrice est connue, elle est en règle due à des germes extrêmement virulents, bien souvent le Pseudomonas aeruginosa, parfois à des mycoses. Neuman rapporte le cas d'une épidémie "d'endophtalmies à Candida" due à la contamination de solutions irrigatrices. Il reproche aux fabricants des solutions d'avoir nié tout d'abord cette infection en rejetant la faute sur les méthodes des chirurgiens. Ainsi un retard de 60 jours pour prévenir les différentes équipes intéressées a été dommageable aux patients et un traitement prophylactique préventif aurait pu être institué plus tôt. De telles observations imposent de changer la solution irrigatrice pour chaque patient. Il est souhaitable d'utiliser un filtre millipore. Les pores en sont de 0,22 ml et retiennent bactéries et micro-particules. Les filtres ne devront contenir aucun détergent ni agent mouillant qui sont très toxiques pour l'œil.
Les solutions à destinée intra-oculaire comme les myotiques et mydriatiques, certains agents hémostatiques, l'alphachymotripsine, peuvent être porteurs de particules ou d'éléments contaminants. Il en est de même des produits visco-élastiques qui ne seraient pas tous stériles mais aseptiques. Il faut donc être très attentif aux produits injectés dans l'œil à l'aguet de toute modification de leur aspect pouvant traduire une contamination. Enfin, il faudra se méfier de mélange dans l'œil, essayer d'injecter un seul produit et d'enlever le visco-élastique avant d'injecter un myotique par exemple dans une chirurgie de la cataracte. La traçabilité de tous ces produits est une exigence qui doit être documentée sur le compte-rendu opératoire. Elle permet l'évaluation de la qualité des soins et son contrôle. Les recommandations sur les appareils de phakoémulsification concerne l'asepsie au niveau pompes et des tubulures de l'appareil. Elles ont donné lieu à une circulaire de la DGS.
La nouvelle circulaire n° 138 de la DGS du 14 mars 2001 a été édictée du fait de l'apparition du nouveau variant responsable de l'encéphalopathie spongiforme transmissible à l'homme. Ce nouveau variant comporte une plus grande infectiosité atteignant l'ensemble du système lymphoïde. Ainsi, sont devenus à risque outre la neurochirurgie et la chirurgie ophtalmologie, les chirurgies O.R.L. et les chirurgies digestives. Dans l'ensemble toute chirurgie portant sur l'ensemble du système lymphoïde. Cela implique donc de mettre en œuvre le plus haut niveau de précaution compatible avec le dispositif médical en fonction du patient et du tissu concerné. Le matériel à usage unique doit donc être privilégié ce d'autant que sont introduit une nouvelle notion outre les actes invasifs en contact avec les tissus du système nerveux central de l'œil et du nerf optique et des formations lymphoïdes, un temps de contact lorsque l'acte est non invasif avec ces tissus ci-dessus. Le temps de contact est fixé arbitrairement à une heure.
Par ailleurs, les facteurs de risque individuel des patients sont bien entendu l'hormone de croissance, les familles de Creutzfeld-Jakob, la neurochirurgie avant janvier 1995. Ne sont plus considérés comme facteurs de risque, un greffé de cornée et un patient ayant subi une intervention neurochirurgicale avant le 1er janvier 1995. Enfin, tout patient est à risque puisque tout le monde à manger de la viande. Ceci est donc devenu un problème planétaire.
En principe, le plus simple est de dédier une pièce à main pour les patients à risque afin de la faire tremper dans la soude à 1 mole pendant une heure pour inactivation des ATNC. La durée de vie de cet appareil est évidemment considérablement réduite. Enfin, pour les patients suspects la destruction reste indispensable. Ceci implique l'existence de protocoles écrits, de procédures de contrôle et l'implication des différents intervenants : le chirurgien ophtalmologique, le CLIN, le pharmacien, l'hygiéniste, le directeur de l'établissement concerné. Enfin, on notera que tout dispositif médical retourné au fabricant pour contrôle ou réparation doit être stérilisé.
L'antisepsie du champ opératoire :
L’étude sur l’analogie entre Staphylococcus epidermidis et les germes du cul de sac conjonctival implique d’éradiquer les germes du cul de sac avant toute chirurgie à globe ouvert.
Dès 1984, Apt et Isenberg montrent que la désinfection du cul de sac conjonctival par la polividone iodée à 5 % réduit considérablement la flore conjonctivale. Cependant, les travaux de Haut et Liotet ont montré qu’environ 20 % des frottis restaient positifs après cette désinfection. La stérilité absolue de la conjonctive pendant quelques heures semble pratiquement impossible à obtenir.
Le spectre d'activité de la PVI couvre les bactéries, les virus et les spores. La plupart des bactéries sont tuées en 30 secondes. Elle n'est pas toxique pour la cornée (PVI sans détergent) contrairement à d'autres antiseptiques cutanés utilisés en milieux chirurgicaux. Il faut proscrire tout antiseptique contenant un détergent ou de l'alcool (Scott Mac Rae et C° 1984).
Isenberg a montré que l’addition d’un antibiotique local instillé trois jours avant l'intervention à l’antiseptique en pré-opératoire serait celle qui réduit le plus grand nombre de germe à la surface conjonctivale, réduisant le nombre de colonies par 99,9 %, et le nombre d'espèces bactériennes par 92 %. Quand ils sont utilisés séparément les antibiotiques instillés trois jours avant l'intervention et la PVI appliqué juste avant l'intervention, entraînent une diminution similaire du nombre d'espèces bactériennes et de colonies. Quand les deux sont associés, la diminution est statistiquement beaucoup plus importante.
|
Cultures stériles
|
|
| Sans traitement |
3%
|
| Après PVI |
31%
|
| Après antibiothérapie |
40%
|
| Après PVI+ antibiothérapie |
83%
|
Cependant, l'instillation d'un collyre antibiotique pose un certain nombre de problèmes. Cette administration d'antibiotiques locaux peut diminuer le nombre de germes mais non pas tous les éradiquer comme l'a montré l'étude de Whitner C.R. Smith C.H. Ces auteurs suggèrent que l'utilisation d'antibiotiques locaux peut favoriser une modification de la flore et le remplacement des bactéries sensibles à ces antibiotiques par des germes qui sont ou qui deviendront résistants à ces antibiotiques. Les diverses études sur la flore conjonctivale ont montré qu'après utilisation d'antibiotiques topique le nombre de germes diminuaient mais n'ont pas pour autant démontré la diminution du nombre d'endophtalmies car il faudrait des dizaines de milliers de cas pour en apporter la preuve statistique. Quoi qu'il en soit si l'on utilise un antibiotique local, il faut qu'il réponde à plusieurs conditions :
- que les germes habituels de la conjonctive soient sensibles à ces antibiotiques
- qu'il réduise le nombre de germes de façon très importante
- qu'il n'y ait pas d'effet secondaire à l'emploi de cet antibiotique
- qu'il soit d'un emploi facile.
Dans ces conditions, quel antibiotique choisir ?. H. Katz et J. Mac Cullen étudiant l’effet des quinolones topiques concluent à l’efficacité supérieure et surtout plus rapide de la Ciprofloxacine par rapport à l’Ofloxacine. La majorité des espèces susceptibles de provoquer une endophtalmie (Staphylococcus aureus, Staphylococcus epidermidis MR ou non, Streptococcus et Pseudomonas) sont détruites entre la 10ème et la 35ème minutes par la Ciprofloxacine topique. Ils préconisent donc spécialement pour la chirurgie ambulatoire l’instillation d’une goutte quatre fois dans l’heure précédant la chirurgie et actuellement d'une instillation trois fois par jour, trois jours avant l'intervention. Ce mode d’administration ne répond pas cependant aux critères d’une antibioprophylaxie chirurgicale, elle n’est qu’une décontamination du cul de sac.
Par ailleurs, l'administration de collyres antibiotiques dans le cul-de-sac ne peut prétendre atteindre des concentrations intra oculaires répondant aux critères d'antibioprophylaxie, c'est-à-dire à des concentrations tissulaires intra-oculaires suffisantes.
Enfin, reste le coût d'une préparation antibiotique versus une préparation antiseptique.
Quoiqu’il en soit à l’heure actuelle, tous les auteurs préconisent l’utilisation de la polyvidone iodée diluée à 5 % pour la préparation du champ opératoire, peau et cul-de-sac pendant deux minutes. D'aucun utilise PVI à 10 % pour la peau. Les réactions d'hypersensibilité immédiate à la PVI sont exceptionnelles (1 seul cas décrit) et sont très rares pour les réactions d'hypersensibilité retardée. Un antécédent de réaction à un produit de contraste iodée ne contre indique pas l'utilisation de PVI.
La désinfection est complétée par la pose de champ non tissé avec fenêtre plastique de type Op-Site.
Les champs non tissés ont un effet barrière contre l'aérocontamination et une moindre perméabilité aux micro-organismes, leur moindre peluchage diminue la suspension des pellicules dans l'air de la salle d'opération. Leur usage unique élimine les risques liés à la réutilisation. Une fenêtre adhésive de type Op-site fixe le champ au pourtour du site opératoire évitant le déplacement vers des champs contaminants vers des zones non protégées. La protection des cils reste difficile : repli du bord du champ plastique Op-site incisé par les branches du blépharostat, pose ou non de stéri-strips sur les cils auparavant.
II - 2 ) Antibioprophylaxie :
Les logiques d'asepsies péri-opératoires et péri environnementales étant bien respectées, interrogeons-nous sur la nécessité d’une antibioprophylaxie (ABP) en chirurgie ophtalmologique. Comme toute ABP, elle doit répondre aux critères de choix et aux modalités d’administration suivantes :
- - L’antibiotique retenu doit être efficace sur le ou les principaux germes contaminants et absent de toxicité générale ou locale.
- - Il doit être présent sur le site potentiellement contaminable avant la contamination, donc en chirurgie oculaire avant l’ouverture du globe.
- - L’antibioprophylaxie est nécessaire et utile jusqu’à la fin de l’intervention. Son utilité cesse dès lors que le risque de contamination cesse. La poursuite du traitement antibiotique après 24 h n’est pas en principe nécessaire, elle n’augmente pas l’efficacité de l’antibioprophylaxie administrée en dose unique pour les chirurgies brèves. Cependant la présence d’une prothèse intra-oculaire plaiderait pour une prophylaxie de 24 H.
- - L’antibiotique doit diffuser à concentration efficace dans le tissu considéré, c’est-à-dire en ophtalmologie pour la voie systémique passer la barrière hémato-oculaire et se trouver à concentrations tissulaires suffisantes, c’est-à-dire supérieures aux CMI des antibiotiques sur les germes habituellement rencontrés.
- - L’antibiotique doit être préférentiellement de nature concentration dépendante.
- - La dose unitaire injectée ne devrait jamais être inférieure à la dose thérapeutique standard.
- - L’antibioprophylaxie doit être d’administration facile.
- - Enfin on devrait rechercher le meilleur rapport coût-efficacité, et en particulier s’interroger sur la réduction du coût des infections par rapport au coût de leur prévention, et au coût des infections évitées.
Aux USA, on a estimé qu'une réduction de 6 % du taux d'infections égalise les coûts de prévention et les coûts d'infections évitées.
A la lumière de ces définitions et de ces raisonnements sur l’antibioprophylaxie admis par tous les spécialistes de l’infection en chirurgie, que peut-on appeler antibioprophylaxie en chirurgie oculaire. En effet, aujourd’hui il n’existe toujours pas de consensus quant à son mode d’administration, quant aux produits employés, ni même quant aux définitions dans notre spécialité.
La chimioprophylaxie péri-oculaire peut-elle conserver ce titre d’antibioprophylaxie? . Elle ne prétend qu’à une décontamination du cul de sac conjonctival par instillation de collyres antibiotiques. En effet l’administration de collyres antibiotiques dans le cul de sac ne peut prétendre atteindre des concentrations intra-oculaires répondant aux critères d’une prophylaxie c’est-à-dire des concentrations tissulaires suffisantes supérieures aux CMI des antibiotiques sur les germes habituellement responsables d’endophtalmie. Pourtant, selon E. Donnenfeld, l'application topique couplée à l'administration systémique multiplie par sept la pénétration intra-vitréenne d'Ofloxacine.
L’administration péri-oculaire sous-conjonctivale d’antibiotiques, du fait de son administration en règle tardive en fin d’intervention, ne répond pas à l’une des conditions générales d’efficacité de l’antibioprophylaxie, à savoir être présent sur le site potentiellement contaminable avant la contamination, donc avant l’ouverture du globe oculaire, et ceci sans compter le fait que certains antibiotiques, comme par exemple les Aminosides ont une pénétration intra-oculaire médiocre et ne peuvent donc être à concentration efficace dans les tissus intra-oculaires.
L’antibioprophylaxie par voie intra-oculaire peut-elle aussi garder son label d’antibioprophylaxie ? Son administration ne se fait que sur un globe ouvert. L’antibiotique n’est donc pas présent sur le site potentiellement contaminable avant la contamination. Par ailleurs, l’antibiotique le plus couramment utilisé à l’heure actuelle est la Vancomycine c’est à dire un antibiotique temps-dépendant qui ne correspond pas en terme de délai à ce que l’on attend d’une prophylaxie antibiotique. Par ailleurs, d'aucun lui reproche de contribuer au développement de Staphylocoques Vancomycine résistant. Le premier reproche suffit à mon sens à ne pouvoir accorder le label d’antibioprophylaxie à cette voie intra-oculaire. L'Oflocet dans le liquide de perfusion pourrait être cependant une alternative complémentaire. Cependant que sait-on de la pénétration dans les tissus oculaires d'une irrigation oculaire ? Quelle quantité d'antibiotique administre-t-on ?
Ce mode d'administration reste donc difficile à "calibrer" mais est probablement une complémentarité à rechercher.
La prévention dans ce cas serait-elle de diminuer ou d'empêcher l'adhérence des SCN producteur de slime ou non et ainsi de réduire l'endophtalmie chronique si l'on s'en rapporte aux expérimentations de Griffiths (1989).
L’antibioprophylaxie par voie générale :
L’administration d’une monothérapie antistaphylococcique à bonne pénétration intra-oculaire, et à bonne biodisponibilité par voie orale en monoprise, compte-tenu de la brièveté des hospitalisations actuelles, voire en deux prises répétées sur 24 heures du fait de la présence d’un implant intra-oculaire, est donc justifiée au terme des différentes définitions exposées ci-dessus. Ainsi l’administration d’une fluoroquinolone, deux heures avant l’intervention avec ou sans prises 12 et 24 heures plus tard, compte-tenu de la pose d’un implant intra-oculaire, pratiquée par de nombreux ophtalmologistes est logique dans l’état actuel de nos connaissances. Dans le critère de choix d’une fluoroquinolone on retiendra la demi-vie du produit, son pic de concentration dans l’humeur aqueuse et sa durée de persistance dans les milieux oculaires. Cependant la possibilité de survenue de tendinopathies communes à toutes les fluoroquinolones, bien que rare, nécessite de bien connaître les facteurs de risque d’administration de cette classe d’antibiotiques. Ainsi une corticothérapie prolongée, des antécédents de tendinite idiopathique ou iatrogénique doivent faire surseoir à l’administration des quinolones et orienter vers le choix d’un autre antistaphylococcique à bonne diffusion intra-oculaire comme par exemple la Fucidine.
La deuxième question qui se pose dans le choix de l’antibioprophylaxie systémique est la suivante : faut-il l’appliquer à tous les patients ou seulement aux patients à risques. La définition des patients à risque reste une nébuleuse relativement floue si l’on excepte le diabète, l’immunodéprimé, le foyer infectieux chronique, l’implant secondaire et le premier oeil perdu par endophtalmie.
Bien que la grande majorité des chirurgiens soient convaincus de l’utilité de l’antibioprophylaxie, il n’existe pas de consensus quant à son mode d’administration, ni quant aux types de produits employés, ainsi qu'en témoignent les résultats de l'enquête nationale sur l'antibioprophylaxie et l'antisepsie dans la chirurgie de la cataracte menée par J.C. MARY en 1997 et ayant recueilli 1082 réponses.
La surveillance régulière de l'incidence des infections par les CLIN.
III) Traitements d'endophtamie après chirurgie de la cataracte
En pratique, la nécessité de la rapidité de mise en route du traitement de l’endophtalmie nécessite un pari bactériologique raisonnable et raisonné à partir des diverses données épidémiologiques exposées précédemment.
III - 1 ) L'examen clinique du patient atteint d'une endophtalmie ne doit pas méconnaître certains éléments sémiologiques prédictifs du pari microbiologiques. Ainsi, l'EVS a individualisé statistiquement les éléments suivants.
Les facteurs démographiques (âge, sexe, race) ne sont pas prédictifs du germe.
Les Staphylocoques coagulase-négative sont plus fréquemment en cause chez le diabétique (58,6 %) que chez le non diabétique (45 %) dans l’EVS. De même, il ressortait de l’étude GEEP que le diabète sucré semblait majorer le risque d’endophtalmie.
Les corticoïdes par voie générale, les antimitotiques et les antibiotiques antérieurs à l'intervention seraient sans influence (GEEP et EVS).
Parmi les signes cliniques :
Le délai de survenue de l’endophtalmie : Un intervalle de moins de 2 jours après l’intervention est plutôt en faveur d’une bactérie à Gram négatif (BGN) (7,4 %) ou d’une bactérie Gram positif (BGP) autre que Staphylococcus coagulase-négative (24,3 %). Le délai moyen d’apparition de l’endophtalmie est de 6 jours dans l’étude américaine.
La douleur n’est pas prédictive du germe (EVS). Par ailleurs on sait qu’elle n’est présente que dans 62,2 % des endophtalmies subaiguës ou retardées (GEEP), et dans 75 % des cas relevés dans l’EVS. Il est donc nécessaire d’insister auprès des opérés afin de consulter au plus vite en post-opératoire non seulement en cas de douleur mais aussi en cas de flou visuel.
Un œdème palpébral, ainsi que la présence de sécrétions, sont statistiquement corrélés à un plus grand pourcentage d’isolement microbiologique de microcoques à Gram positif non epidermidis (26,2 %) qu’en l’absence d’œdème palpébral (13,5 %). De même, les endophtalmies totalement asymptomatiques sont corrélées à une absence de germes isolés lors des cultures.
L’acuité visuelle à l’arrivée du patient, serait prédictive des résultats microbiologiques. Une acuité visuelle initiale égale à « perception lumineuse » serait plutôt en faveur d'une BGN (8,2 %) ou d’une BGP autre que Staphylococcus epidermidis (31,8 %). De même, un infiltrat cornéen, une déhiscence de la cicatrice, une irrégularité pupillaire, la non-transparence des milieux, une bulle filtrante, une rupture capsulaire avec incarcération du vitré sont prédictifs de germes plus virulents.
L’existence, et surtout la hauteur de l’hypopion, orienteraient vers une microbiologie plus évocatrice. Un hypopion supérieur à 1,9 mm évoque la présence d’une BGP ; une hauteur de 1,7 mm, celle d’une BGN, 1,2 mm un staphylocoque coagulase-négative. En cas d’hypopion inférieur à 1 mm, aucun germe n’est retrouvé à la ponction.
Lors de l’examen initial de l’endophtalmie, si le fond d’œil est analysable, aucun germe Gram négatif n’a été retrouvé et 61,9 % de ces cas sont dus soit à un Staphylococcus epidermidis, soit aucun germe n’a été isolé. Une telle situation pourrait éventuellement justifier d’une monothérapie antibiotique intra-oculaire selon les rapporteurs de l’EVS.
Ainsi pour l’EVS, l’analyse de 4 facteurs peut faire suspecter le germe causal. Il s’agit d’un délai post-opératoire court (moins de 2 jours), d’une acuité visuelle limitée à « perception lumineuse », de la présence d’anomalies pupillaires et de l’absence de lueur pupillaire. La présence de 2 critères ou plus est prédictif de 50 % ou plus de chance de développer une infection à BGN ou à BGP autres que Staphylococcus coagulase-négative.
Les autres facteurs cliniques prédictifs de la nature du germe : l'anamnèse de l'acte chirurgical
Les incidents per-opératoires : En cas de rupture capsulaire postérieure, d’issue de vitré ou de vitrectomie antérieure, aucune différence significative concernant le panel des germes responsables n’a été retrouvée, bien que le risque d’endophtalmie après de tels incidents soit majoré pour l’EVS et d’autres études. Ce dernier point était en contradiction avec l’étude GEEP.
Le siège de l’implant : Les implants de chambre postérieure sont corrélés de manière significative (1,5 fois plus) à des infections dues à Staphylococcus coagulase-négative (51,8 % versus 34,0 % pour les implants de chambre antérieure). Un facteur de confusion dans l’interprétation de ce résultat pouvant être attribué à le faible proportion des implants de chambre antérieure, notamment lors des implantations secondaires. Une autre hypothèse serait une différence d’adhésion des germes aux différents matériaux des implants de chambre postérieure. Cette hypothèse n’ayant pas été explorée au cours de l’EVS.
Implantation primaire ou secondaire : De même, l’implantation secondaire, est corrélée à un risque moindre d’infection par les staphylocoques coagulase-négative que lors d’une implantation de première intention (21,7 % versus 48,4 %), et à deux fois plus d’infection par d’autres germes à Gram positif (30,4 % versus 14,6 %).
Cependant, ces suspicions ne sont pas suffisantes, la recherche de la preuve microbiologique reste indispensable.
III - 2 ) Conduite thérapeutique
Elle comporte deux règles :
- une règle diagnostique nécessitant des prélèvements endoculaires devant toute endophtalmie suspectée,
- une règle thérapeutique imposant l’injection intra-oculaire d’une bithérapie antibiotique.
III - 2 - 1) Règle diagnostique
Les méthodes de prélèvement : sont standardisés de longue date, et doivent faire partie de la conduite à tenir de toute endophtalmie déclarée.
La recherche du germe se fait à partir de la ponction de chambre antérieure, associée à la ponction de vitré, ou à la biopsie de vitré avec mise en culture immédiate selon une méthodologie rigoureuse. Ces prélèvements sont pratiqués dès le diagnostic d’endophtalmie posé, avant toute antibiothérapie.
La ponction de chambre antérieure prélève 0,1 ml d’humeur aqueuse à l’aide d’une aiguille de 25 à 27 gauge.
Trois méthodes sont possibles pour le prélèvement du vitré ainsi que le rapporte l’EVS : la ponction du vitré, la biopsie du vitré isolée ou en préalable à la vitrectomie.
De fait, les prélèvements de vitré par aspiration à l’aiguille et à la seringue sont de pratique difficile. Ils peuvent induire des tractions vitréennes indésirables, sur ce vitré inflammatoire, compartimenté par l’infection et dont la rétine est fragilisée et friable.
La biopsie du vitré à travers une sclérectomie à la pars plana doit être réalisée avant de prélever un échantillon d’humeur aqueuse à travers une incision limbique.
La membrane pupillaire fibrineuse est quasi toujours présente et doit être enlevée avec une pince ou une aiguille après avoir rempli la chambre antérieure de viscoélastique. L’ablation de cette membrane est essentielle pour obtenir une bonne visualisation pour réaliser une éventuelle vitrectomie. Lors d’une vitrectomie, le prélèvement du vitré est réalisé grâce à l’installation d’un piège à mucosité sur la ligne d’aspiration. Ceci permet l’aspiration initiale d’un échantillon vitréen peu dilué en vue des examens microbiologiques. Ces échantillons d’humeur aqueuse et de vitré doivent être portés sans retard au laboratoire de microbiologie. Le reste du liquide d’aspiration de la vitrectomie peut être recueilli à partir de la cassette d’aspiration et centrifugé pour obtenir un échantillon plus concentré
Un examen direct par une coloration de Gram et des cultures bactériennes aérobie, anaérobie et fongique sont réalisées sur le produit de ces prélèvements. Les cultures sont effectuées sur différentes géloses, milieu enrichi au sang, milieu chocolat, et milieu de Sabouraud etc… et des milieux liquides. L’incubation doit être réalisée sous diverses atmosphères, à 37° pendant un temps prolongé de 5, voire 10 jours. Les antibiotiques testés dans l’EVS ont été l’Amikacine, la Vancomycine, la Ceftazidime, l’Oxacilline et la Ciprofloxacine.
La ponction du vitré est plus contributive que la ponction de chambre antérieure. Ce fait, connu de longue date, a de nouveau été confirmé par ces deux études prospectives, soulignant une fois de plus la nécessité de ces prélèvements pour identifier le germe responsable.
III - 2 - 2 ) Quels antibiotiques choisir pour l’injection intra-oculaire ?
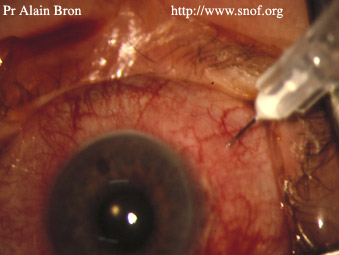
Injection intra-vitréenne d'antibiotique
L’on sait que 94,2 % des germes responsables d'endophtalmies sont des BGP sont sans exception dans l’EVS sensibles à la Vancomycine. Ainsi, l’injection intra-vitréenne doit obligatoirement comporter cet antibiotique (1 mg de Vancomycine dans 0,1 ml d’eau distillée). Cependant, l’existence d’endophtalmie à BGN, bien que leur incidence soit beaucoup plus faible, mais du fait d’un pronostic plus sévère, conduit à préconiser l’injection d’un deuxième antibiotique Amikacine (0,20 mg dans 0,1 ml de BSS) ou Ceftazidime (2,25 mg de Fortum® dans 0,1 ml de BSS).
Depuis les publications de Campiocharo, l’Amikacine est préféré aux autres aminosides, en particulier, la Gentamicine, du fait d’une moindre toxicité intra-oculaire qui réduirait le risque d'ischémie maculaire. Il faut cependant rester réservé sur les injections d’aminosides quel qu'ils soient dans l’œil, ce d’autant plus que l’injection est effectuée conjointement à une vitrectomie ou qu’il s’agisse d’une deuxième injection.
A la suite de l’EVS, il est donc raisonnable de pratiquer une bi-antibiothérapie par voie intra-vitréenne comportant obligatoirement la Vancomycine associée à l’Amikacine ou la Ceftazidime.
La toxicité rétinienne des antibiotiques injectés limite la répétition des injections. Cependant, on peut injecter cette bithérapie à trois jours d’intervalle, puis la répéter une fois par semaine pendant deux semaines (7 % de réinjections dans l’EVS).
Quid de l’antibiothérapie systémique ?
En se reportant à l’étude de la sensibilité aux fluoroquinolones sur les germes isolés lors de l’EVS, il apparaît que Staphylococcus epidermidis est sensible pour 77,9 % à la Ciprofloxacine et 62,7 % à l’Oxacilline ; Staphylococcus aureus est sensible dans 81,3 % à la Ciprofloxacine et 78,6 % à l’Ofloxacine. Ainsi, se justifie l’utilisation par voie systémique d’antibiotiques actifs sur les Staphylocoques et ayant une bonne pénétration intra-oculaire tels sont les Fluoroquinolones, la Fosfomycine ou l’Imipénème. L’institution d’une bithérapie est nécessaire pour éviter le développement de résistance.
La voie systémique permet d’atteindre, après l’administration de doses répétées, l’état d’équilibre où la concentration d’antibiotique dans l’organe cible est supérieure aux CMI90 de la plupart des germes responsables d’endophtalmies ainsi que l’ont montré les études de pharmacocinétiques sur la Pefloxacine et la Ciprofloxacine.
La conclusion de l’EVS niant le bénéfice de l’antibiothérapie systémique est excessive ne tenant compte ni de l’épidémiologie des germes, ni de la cinétique des antibiotiques et ni du spectre antibactérien des antibiotiques choisis (Amikacine et Ceftazidime) pour cette étude.
D’autres antibiotiques peuvent être utilisés en fonction de l’identification du germe en cas d’inefficacité thérapeutique de l’antibiotique empiriquement choisi.
Quid de la corticothérapie ?
Dès 1974, Peyman a rapporté la preuve histologique de l’efficacité de la corticothérapie par voie intra-vitréenne pour lutter contre l’inflammation aiguë associée à l’endophtalmie. Ainsi comme l’a préconisé F. Auclin, il nous paraît nécessaire d’injecter de la dexaméthasone (200 à 400 µg) lors de l’injection intra-oculaire d’antibiotique sauf en cas de suspicion d’endophtalmie fongique , et de prescrire des corticoïdes en bolus intra-veineux (250 à 500 mg de Solumédrol) dès le deuxième jour du traitement antibiotique par voie systémique et ceci pendant trois jours, en l’absence de contre-indication d’ordre général.
Quelle place pour la vitrectomie ?
La question de la vitrectomie reste un choix difficile quant à ses indications et sa date de réalisation. Elle a été réalisée dans 50 % des cas dans l’étude GEEP, et dans 52 % des cas dans l’EVS.
Dans cette dernière étude, sous réserve de critères d’inclusion stricts (AV < 1/10, visualisation de l’iris suffisante mais trouble des milieux ne permettant pas de définir au FO les artérioles de deuxième ordre, et cornée suffisamment claire pour réaliser une vitrectomie), l’effet bénéfique immédiat pour les cas où l’acuité visuelle est réduite à une perception lumineuse est statistiquement significatif. Les facteurs microbiologiques ne sont d’aucune utilité quant à l’indication de vitrectomie. C’est donc l’acuité visuelle témoin non seulement de la virulence du germe, de la durée de l’infection et de la réponse immunitaire du patient qui serait le meilleur argument pour poser l’indication d’une vitrectomie.
Les yeux vitrectomisés ont trois fois plus de chances ( 33 % vs 11 %) d’obtenir une acuité visuelle finale supérieure ou égale à 5/10 et deux fois moins de risque d’évoluer vers une acuité inférieure à 2/10 (56 % versus 30 %) que ceux n’ayant eu qu’une ponction de vitré. Par ailleurs, les complications (décollement de rétine et phtyse) ne sont pas plus fréquentes. L’aggravation des signes cliniques peut conduire à programmer une vitrectomie différée sur un œil déjà imprégné par une antibiothérapie systémique.
Conclusion
La prévention de l'infection en chirurgie oculaire revêt des aspects multiples et complexes faisant appel aux connaissances les plus récents en matières d'hygiène des blocs chirurgicaux, de matériovigilance, de microbiologie, de thérapeutiques antiseptiques et antibiotiques. Cet ensemble de mesure vise à réduire l'incidence de l'endophtalmie et à en diminuer la gravité.
Bibliographie
:1 - ADENIS J.P.
Les injections intraoculaires d’antibiotiques ou d’antifongiques dans le traitement des infections graves du globe.
J. Fr. Ophtalmol. 1986 ; 9 : 403-410.
2 - ALLEN H.F., MANGIARACINE A.B.
Bacterial endophthalmitis after cataract extraction : a study of 22 infections in 20,000 operations.
Arch. Ophthalmol. 1964 ; 72 : 454-462.
3 - AUCLIN F., ULLERN M.
Intérêt des corticoïdes dans le traitement de l’endophtalmie post-opératoire.
J. Fr. Ophtalmol. 1993 ; 16 : 446-452.
4 - BARZA M.
Factors affecting the intraocular penetration of antibiotics : the influence of route, inflammation, animal species and tissue pigmentation.
Scand J. Infect. Dis. Supp. 1978 ; 14 : 151-159.
5 - BOHIGIAN G.M., OLK R.J.
Factors associated with a poor visual results in endophthalmitis.
Am. J. Ophthalmol. 1986 ; 101 : 332-341.
6 - BRON A.M, PECHINOT A.P, GARCHER C P., GUYONNET G. A., KAZMIERCZAK A.M., SCHOTT D.A., and LECOEUR H.
The Ocular Penetration of Oral Sparfloxacin in Humans
Am. J. Ophthalmol. 1994 ; 117 : 322-327
7 - BURILLON C., ROURE C., REVERDY M.E., MARTRA A., ETIENNE J.
Adhésion du staphylococcus epidermidis sur les lentilles intraoculaires. Etude in vitro.
Ophtalmologie 1997 ; 11 : 326-328.
8 - CAMPOCHIARO P.A., LIM J.I., the Aminoglycoside Toxicity Study Group
Aminoglycoside toxicity in the treatment of endophthalmitis.
Arch. Ophthalmol. 1994 ; 112 : 48-53.
9 - DIAMOND J.G.
Intraocular management of endophthalmitis.
Arch. Ophthalmol. 1981 ; 99 : 96-99.
10 - DOYLE A., BEIGI B., EARLY A., BLAKE A., EUSTACE P., HONE R.
Adherence of bacteria to intraocular lenses : a prospective study.
Br. J. Ophthalmol. 1995 ; 79 : 347-349.
11 - Endophthalmitis Vitrectomy Study Group
Results of the Endophthalmitis Vitrectomy Study
A randomized trial of immediate vitrectomy and of intravenous antibiotics for the treatment of postoperative bacterial endophthalmitis.
Arch. Ophthalmol., 1995 ; 113 : 1479-96.
12 - Endophthalmitis Vitrectomy Study Group
Spectrum and susceptibilities of microbiologic isolates in the endophthalmitis vitrectomy study.
Am. J. Ophthalmol., 1996 ; 122 :1-17.
13 - Endophthalmitis Vitrectomy Study Group
Microbiologic factors and visual outcome in the endophthalmitis vitrectomy Study.
Am. J. Ophthalmol., 1996 ; 122 : 830-46.
14 - Endophthalmitis Vitrectomy Study Group
Relationships between clinical presentation and microbiologic spectrum.
Ophthalmology 1997 ; 104 : 261-72.
15 - Endophthalmitis Vitrectomy Study Group
The source of coagulase-negative staphylococci in the endophthalmitis vitrectomy study. A comparison of eyelid and intraocular isolates. Using pulsed-fiels gel electrophoresis.
Arch. Ophthalmol. 1997 ; 115 : 357-60.
16 - Endophthalmitis Vitrectomy Study Group
Evaluation of microbiological diagnostic techniques in postoperative endophthalmitis in the endophthalmitis vitrectomy study.
Arch. Ophthalmol. 1997 ; 115 : 1142-50.
17 - FEYS J., EMOND J.P., SALVANET-BOUCCARA A., DUBLANCHET A.
Etude bactériologique du liquide intra-oculaire en fin d’intervention de cataracte.
J. Fr. Ophtalmol., 1993, 16, 10, 501-505.
18 - FORSTER R.K.
Etiology and diagnosis of bacterial endophthalmitis [Symposium].
Trans. Am. Acad. Ophthalmol. 1978 ; 85 : 320-326.
19 - GRIFFITHS P.G., ELLIOT T.S.J., and TAGGART L.
Adherence of staphylococcus epidermidis to intraocular lenses.
Br. J. Ophthalmol., 1989, 73 : 402-406.
20 - HAUT J., LIOTET S., QUESNOT S.
Rôle de l’antisepsie dans le traitement chimio-antibiotique prophylactique de l’endophtalmie post-opératoire.
J. Fr. Ophthalmol. 1993 ; 16 : 595-601.
21 - HAUT J., ROBIN H., AMELINE B.
Traitement chimioantibiotique prophylactique de l’endophtalmie post-opératoire en chirurgie réglée à globe ouvert.
J. Fr. Ophtalmol. 1991 ; 14 : 537-545.
22 - KATZ H.R., PERLMUTTER L.S.
The use of topical fluoroquinolones to reduce conjonctival flora in human subjects for surgical prophylaxis.
E.S.C.R.S. avril 1999, Seattle.
23 - LAGOUTTE F., FOSSE T., JASINSKI M., SARRAZIN B., EYCHENNE J.L.,
SAUDUBRAY F., BEDJAOUI A., FLEURETTE J.
Polyvidone iodée (bétadineÒ) et prévention de l’infection postopératoire.
Etude multicentrique.
J.Fr. Ophtalmol., 1992, 15, 1, 14-18.
24 - MARY J.C., SALVANET-BOUCCARA A., FORESTIER F., BRASSEUR G.
Résultats d’une enquête nationale concernant l’antibioprophylaxie et l’antisepsie dans la chirurgie de la cataracte.
J. Fr. Ophtalmol., 1998, 21, 9, 627-635.
25 - MEREDITH T.A., AGUILAR H.E., TRABELSI A., MILLER M.J.,
GARDNER S.K., WILSON L.A.
Comparative treatment of experimental Staphylococcus epidermidis endophthalmitis.
Arch. Ophthalmol. 1990 ; 108 : 857-860.
26 - PEYMAN G.A., VASTINE D.W., RAICHAND M.
Postoperative endophthalmitis experimental aspects and clinical applications.
Trans. Am. Acad ; Ophthalmol. 1978 ; 85 : 374-379.
27 - PULIAFITO C.A., BAKER A.S., HAAF J., FOSTER C.S.
Infectious endophthalmitis, review of 36 cases.
Ophthalmology 1982 ; 89 : 921-929.
28 - RIBAUTE E., CORLAY J.P., DARY J.
Incidence de l’endophtalmie post-opératoire après utilisation de Vancocine intracamérulaire. Etude rétrospective sur 1000 cataractes consécutives.
Ophtalmologie 1994 ; 8 : 229-230.
29 - ROWSEY J.J., JENSEN H., SEXTON D.J.
Clinical diagnosis of endophthalmitis.
Int. Ophthalmol. Clin. 1987 ; 27 : 82-88.
30 - SALVANET-BOUCCARA A., DUBAYLE Ph., FORESTIER F., LAFAIX Ch.,
HAROCHE G., DUBLANCHET A.
Vers une stratégie raisonnée du traitement des endophtalmies bactériennes post-opératoires.
J. Fr. Ophtalmol., 1986, 9, 8-9, 523-532.
31 - SALVANET-BOUCCARA A., FORESTIER F., COSCAS G., ADENIS J.P.,
DENIS F.
Groupe d’Etude Multicentrique des Endophtalmies.
Endophtalmies bactériennes. Résultats ophtalmologiques d’une enquête prospective multicentrique nationale.
J. Fr. Ophtalmol., 1992, 15, 12 : 669-678.
32 - SALVANET-BOUCCARA A., DUBAYLE PH, FORESTIER F., LAFAIX C.,
DUBLANCHET A., ANTIPHON P.
Endophtalmies post-opératoires à pneumocoques.
J. Fr. Ophtalmol. 1984 ; 7 : 535-538.
33 - SPEAKER M.G., MILCH F.A., SHAH M.K., EISNER W., KREISWIRTH B.N.
Role of external bacterial flora in the pathogenesis of acute postoperative
endophthalmitis.
Ophthalmology 1991 ; 98 : 639-650.
34 - WEBER D.J., HOFFMAN K.L, THOFT R.A., BAKER A.S.
Endophthalmitis following intraocular lens implantation. Report of 30 cases
and review of the literature.
Rev. Infect. Dis. 1986 ; 8 : 12.20.